| 2-methyltetrahydrofuraan | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van 2-methyltetrahydrofuraan
| ||||
| Algemeen | ||||
| Molecuulformule | C5H10O | |||
| IUPAC-naam | 2-methyloxolaan | |||
| Andere namen | tetrahydrosylvaan | |||
| Molmassa | 86,1323 g/mol | |||
| SMILES | CC1CCCO1
| |||
| InChI | 1/C5H10O/c1-5-3-2-4-6-5/h5H,2-4H2,1H3
| |||
| CAS-nummer | 96-47-9 | |||
| EG-nummer | 202-507-4 | |||
| PubChem | 7301 | |||
| Wikidata | Q209444 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H225 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P210 | |||
| VN-nummer | 2536 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 0,86 g/cm³ | |||
| Smeltpunt | −136 °C | |||
| Kookpunt | 78-80 °C | |||
| Vlampunt | −11,1 °C | |||
| Slecht oplosbaar in | water | |||
| Brekingsindex | 1,4046 - 1,4066 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
2-methyltetrahydrofuraan (afkorting 2-MeTHF) is een organische verbinding met als brutoformule C5H10O. De stof komt voor als een kleurloze vloeistof, die qua eigenschappen sterk vergelijkbaar is met het analoge tetrahydrofuraan (THF). 2-MeTHF wordt gezien als een groener alternatief voor THF gezien 2-MeTHF gesynthetiseerd kan worden uit plantaardige bronnen en THF van petrochemische origine is.
Synthese
2-methyltetrahydrofuraan wordt op industriële schaal bereid door de pyrolyse en dehydratatie van een aantal suikers, voorbeelden zijn levuline, glucose en fructose. Een veel toegepaste route is de hydrogenering van furfural.
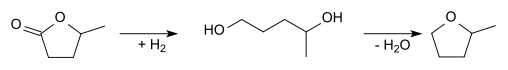
In het laboratorium kan het ook bereid worden uit levulinezuur, dat achtereenvolgens gecycliseerd en gehydrogeneerd wordt tot γ-valerolacton:
Dit lacton wordt vervolgens geopend door toevoer van waterstofgas, zodat 1,4-pentaandiol ontstaat. Dit kan onder toevoegen van een sterk zuur cycliseren tot 2-methyltetrahydrofuraan:
Toepassingen
2-methyltetrahydrofuraan wordt beschouwd als een milieuvriendelijk oplosmiddel. Het heeft een aantal voordelen ten opzichte van tetrahydrofuraan in de toepassingen op grote schaal. Het mengt slecht met water en het kan eenvoudiger worden gedroogd door distillatie, omdat het een lagere azeotroop (71 °C) vormt. Met andere woorden: water kan gemakkelijker verwijderd worden door distillatie. Dit is vooral een voordeel gebleken wanneer met waterige oplossingen van natriumhydroxide wordt gewerkt. Een nadeel is echter dat het oplosmiddel een pak duurder is dan het veelgebruikte tetrahydrofuraan.
Deze ether wordt voornamelijk bij Grignard-reacties als oplosmiddel ingezet, omdat het in situ gevormde organomagnesiumreagens coördinatief kan gestabiliseerd worden.