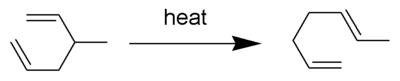
De Cope-omlegging is een uitgebreid bestudeerde organische reactie (omlegging) waarbij een [3,3]-sigmatrope omlegging optreedt van een 1,5-dieen.[1][2][3][4] De reactie is voor het eerst bestudeerd door Arthur C. Cope, vandaar de naam. In onderstaand voorbeeld wordt 3-methyl-1,5-hexadiene verwarmd tot 300 °C waarbij 1,5-heptadiene gevormd wordt.
De Cope-omlegging is ook verantwoordelijk voor de omleggingen die optreden in de bullvalenen.
Reactiemechanisme
Hoewel is aangetoond dat de Cope-omlegging via een geconcerteerde reactie en pericyclisch verloopt, kan de reactie ook op een andere manier beschreven worden. De overgangstoestand kan beschouwd worden als energetisch en structureel equivalent aan een diradicaal. Deze manier van beschrijven doet recht aan het feit dat er een ladingscheiding optreedt tijdens de reactie en ook wordt recht gedaan aan het behoud van orbitaal symmetrie tijdens de reactie. Ook de hoge activeringsenergie zou hiermee voldoende verklaard worden. In onderstaande figuur is de omlegging weergegeven in de stoelvorm, maar ook omleggingen in de bootvorm zijn mogelijk.
Voorbeeld
De omlegging wordt uitgebreid toegepast in de organische synthese. De omlegging is Woodward–Hoffmann regels toegestaan als alle componenten ten opzichte van elkaar suprafaciaal staan. In de overgangstoestand gaat het molecule door een stoel- of bootvorm. Een voorbeeld van de cope omlegging is de ring-expansie van de cyclobutaanring naar de 1,5-cyclo-octadieenring:
In in dit geval verloopt de reactie via een bootvormige overgangstoestand in de vorming van de twee cis-dubbele bindingen. Een trans-binding in de acht-ring zou tot te grote ringspanning leiden. De reactie verloopt onder thermische condities, de drijvende kracht achter de reactie is de opheffen van de ringspanning van de cyclobutaanring.
Oxy-Cope-omlegging
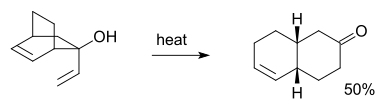
In de Oxy-Cope-omlegging is in de uitgangsstof een hydroxylgroep aanwezig op C3. Het als eerste gevormde enol legt snel via de Keto-enol tautomerie om naar het isoleerbare product: een "enal" (een aldehyde én een dubbele band in één molecule[5][6]:
Bovenstaand schema is in onderstaande synthese toegepast:
Variaties
Een andere variatie wordt gevormd door reacties waarbij een van de koolstofatomen door een heteroatoom vervangen is, bijvoorbeeld stikstof in de Aza-Cope omlegging. Een nauw verwante [3,3]-sigmatrope omlegging is door Claisen beschreven.
- ↑ Arthur C. Cope; et al.; J. Am. Chem. Soc. 1940, 62, 441.
- ↑ Rhoads, S. J.; Raulins, N. R.; Org. React. 1975, 22, 1-252. (Review)
- ↑ Hill, R. K.; Comp. Org. Syn. 1991, 5, 785-826.
- ↑ Wilson, S. R.; Org. React. 1993, 43, 93-250. (Review)
- ↑ A Synthesis of Ketones by the Thermal Isomerization of 3-Hydroxy-1,5-hexadienes. The Oxy-Cope Rearrangement Jerome A. Berson, Maitland Jones, Jr. J. Am. Chem. Soc. 1964; 86(22); 5019-5020. DOI:10.1021/ja01076a067
- ↑ Stepwise Mechanisms in the Oxy-Cope Rearrangement Jerome A. Berson and Maitland Jones pp 5017 - 5018; J. Am. Chem. Soc. 1964; DOI:10.1021/ja01076a066