
In de strikte zin van het woord worden in de organotinchemie verbindingen bestudeerd waarin een directe binding voorkomt tussen koolstof en tin. In een minder strikte zin van de term worden ook organische reacties bestudeerd waarbij tin een essentiële rol speelt. In analogie met de silanen worden organotinverbindingen die afgeleid zijn van alkanen ook wel stannanen genoemd. Tin is een metaal, de organotinchemie is daarmee een subdiscipline van de organometaalchemie.[1]
In 1849 werd de eerste organotinverbinding beschreven door Edward Frankland: di-ethyltindi-jodide. Organotinverbindingen worden commercieel toegepast bij het neutraliseren van waterstofchloride in pvc en als biocide. Tributyltinoxide is veel gebruikt bij het beschermen van hout. Tributyltinverbindingen zijn veel toegepast in de mariene anti-aanslagverven. Uiteraard zijn anti-aanslagmiddelen giftig, maar de gebruikte tinverbindingen zijn dat voor veel meer zeeorganismen dan waar anti-aanslagmiddel voor wordt toegepast.[2] Wereldwijd is daarom door de Internationale Maritieme Organisatie een verbod op het gebruik van anti-aanslag op basis van tin afgekondigd. n-butyltintrichloride wordt toegepast bij het vormen van een laagje tin(IV)oxide op glaswerk via chemical vapor deposition (CVD).
Synthese van organotinverbindingen
Organotinverbindingen kunnen bereid worden in een grignardreactie met een tinhalide zoals tin(IV)chloride. Ook tinhalogeniden waaraan een deel van de chlooratomen al vervangen is door organische groepen ondergaan deze reactie. Een voorbeeld van een dergelijke synthese is die van tributyl-[(Z)-5-fenyl-2-penten-2-yl]stannaan.[3] Het grignardreagens wordt gemaakt op basis van magnesiumkrullen en (Z)-2-broom-5-fenyl-2-penteen in droge tetrahydrofuraan. Vervolgens wordt tributyltinchloride via een buret toegevoegd totdat het reactiemengsel ontkleurt, eigenlijk een titratie. Het reactiemengsel wordt nog een uur bij kamertemperatuur geroerd, waarna het oplosmiddel met behulp van een rotavapor verwijderd wordt. Na toevoegen van di-ethylether, wassen met brijn, filtreren en opnieuw oplosmiddel met de rotavapor verwijderen wordt het ruwe product verkregen. Na destillatie wordt tributyl-[(Z)-5-phenyl-2-penten-2-yl]stannaan als een kleurloze olie geïsoleerd.
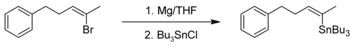
De Wurtz-achtige reactie tussen alkylnatriumverbindingen en tinhalogeniden levert tetragesubstitueerde organotinverbindingen. Een andere benadering is de uitwisselingsreactie tussen tinhalogeniden en organoaluminiumverbindingen van de vorm AlR3. Triorganotinhalogeniden worden verkregen via de Kochesjkov-redistributiereactie.
Reacties van organotinverbindingen
Belangrijke reacties van organotinverbindingen zijn onder andere
- de Stille-reactie (palladium is katalysator in de koppelingsreactie tussen sp2-gehybridiseerde organische halogeniden):
- organostannaanaddities, de nucleofiele additie van stannanen met een allyl-, allenyl-, of propargylgroep aan aldehyden en imines.
- Triorganotinhydriden worden op laboratoriumschaal gebruikt bij het vervangen van halogenen aan verzadigde koolstofatomen door waterstof.
Toepassingen en giftigheid
- De tetraorganotinverbindingen (R4Sn) zijn stabiele stoffen die nauwelijks toxisch of bioactief zijn. Als biocide zijn ze niet geschikt. De lage bioactiviteit verhindert niet dat de verbindingen tijdens hun metabole omzettingen tot triorganotinverbindingen geactiveerd kunnen worden. Op basis van deze stoffen worden een aantal katalysatoren samengesteld.
- Triorganotinverbindingen (R3SnL; L is een niet-koolstofligand aan tin) zijn zeer toxisch. Als de drie organische groepen van het n-alkyltype zijn, zijn de verbindingen fytotoxisch en kunnen dus niet in de landbouw worden toegepast. Afhankelijk van het R-groepen zijn de verbindingen sterke bactericides of fungicides. Industrieel wordt tributyltinhydride als biocide toegepast bijvoorbeeld in textiel, papier, brouwerijen en industriële koelsystemen. De stoffen werden toegepast als mariene anti-aanslagverf. Trifenyltinverbindingen worden toegepast als actieve component van schimmelwerende verf of in de landbouw toegepaste fungicides. Andere verbindingen uit deze groep worden toegepast als acaricide.
- De diorganotinverbindingen (R2SnL2) hebben geen antischimmelactiviteit, zijn zowel laag-toxisch als antibacteriële middelen. Difenyltinverbindingen vormen hierop een uitzondering. Diorganotinverbindingen vinden toepassing als warmtestabilisatoren in polymeren als pvc en katalysatoren in de bereiding van polyurethaan. DBT is echter immunotoxisch: in 2008 is een verband gesuggereerd met auto-immuungerelateerde ziektes.[4]
- Mono-organotinverbindingen (RSnL3) hebben geen biocide-activiteit en zijn ook voor zoogdieren nauwelijks giftig. Methyltin, butyltin, octyltin en mono-estertinverbindingen vinden ook toepassing als warmtestabilisatoren voor pvc.
- Als mogelijk antikankermiddel is een groot aantal organotinverbindingen onderzocht, waarbij al gebleken is dat ze meer cytotoxisch zijn en een hogere affiniteit hebben dan cisplatine.[5]
Verbindingen
Organotinverbindingen vinden een groot aantal commerciële toepassingen zoals biocides, insecticides, tussenstoffen in chemische syntheses en als katalysator.
- Belangrijke
-
Tetrabutyltin is een uitgangsstof voor di- en tributylverbindingen.
-
Tributyltinoxide is een kleurloze tot bleek-gele olie die toegepast wordt bij de houtbescherming.
-
Trifenyltinchloride is een witte kristallijne stof die als biocide en intermediair in chemische syntheses wordt ingezet.
-
Trimethyltinchloride is een biocide.
-
Trifenyltinhydroxide is een wit poeder dat gebruikt wordt als fungicide.
-
Azocyclotin is een kleurloze kristallijne stof die gebruikt wordt als lang actief acaricide ter bestrijding van spint op planten.
-
Cyhexatin is een witte kristallijne stof, die ingezet wordt als acaricide.
-
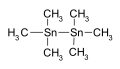
Hexamethylditin is een tussenstof in chemische syntheses.
Andere groepen organotinverbindingen
Polystannanen zijn polymere stannanen van het type (SnR2)n

Stannool is het tin-analoog van pyrrool. Onverzadigde organostannanen zijn ook beschreven: stannenen. Dit zijn verbindingen van het type RRC=SnRR met een formele dubbele binding tussen koolstof en tin (zie ook stannabenzeen), en distannenen met een dubbele tin-tin-binding: RRSn=SnRR. Een stannyn heeft een drievoudige binding tussen koolstof en tin, een distannyn bezit de drievoudige binding tussen twee tinatomen (RSn≡SnR). Tinradicalen worden stannylradicalen genoemd, tin-carbenen stannylenen (RSn:).[7]
Hypergecoördineerde stannanen
In tegenstelling tot koolstof met als hoogste coördinatiegetal 4, zijn voor tin coördinatiegetallen van 5 en zelfs 6 mogelijk. In deze zogenaamde hypergecoördineerde verbindingen zijn vaak elektronegatieve substituenten ter stabilisatie aanwezig. Lithiumpentaorganostannaten waren in 1986 de eerste in deze klasse ontdekte verbindingen,[8] terwijl in het daarop volgende jaar een tetraorganotinverbinding met coördinatiegetal 6 werd gepubliceerd.[9] In 2007 is de kristalstructuur van onderstaande verbinding gerapporteerd. De stof is bij kamertemperatuur (en onder argonatmosfeer) stabiel en heeft 5 koolstofliganden aan tin gebonden.[10]
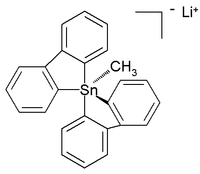
In deze verwrongen trigonale bipiramide bedraagt de bindingslengte tussen koolstof en tin 226 picometer voor de apicale bindingen en 217 pm voor de equatoriale bindingen. In beide gevallen is de binding, ten gevolge van de hypervalentie (eigenlijk te weinig elektronen beschikbaar, of te weinig ruimte) langer dan de standaardwaarde van 214 pm.
- National Pollutant Inventory Fact Sheet for organotins
- Industry information site
- Organotin chemistry in synthesis
- EU bans certain organotin compounds in consumer products
- ↑ Sander H.L. Thoonen, Berth-Jan Deelman, Gerard van Koten (2004). Synthetic aspects of tetraorganotins and organotin(IV) halides. Journal of Organometallic Chemistry (689): 2145–2157.
- ↑ Gajda, M., Jancso, A. (2010). Organotins, formation, use, speciation and toxicology. Metal ions in life sciences 7, Organometallics in environment and toxicology (RSC publishing: Cambridge).
- ↑ Martin J. Stoermer, John T. Pinhey (1998). Tributyl-[(Z)-5-phenyl-2-penten-2-yl]stannane. Molecules 3: M67.
- ↑ C Gumy et al. (2008). Dibutyltin Disrupts Glucocorticoid Receptor Function and Impairs Glucocorticoid-Induced Suppression of Cytokine Production. PLoS ONE 3. DOI: 10.1371/journal.pone.0003545.
- ↑ S. Gómez-Ruiz et al. (2008). Study of the cytotoxic activity of di and triphenyltin(IV) carboxylate complexes. Journal of Inorganic Biochemistry 102: 2087. DOI: 10.1016/j.jinorgbio.2008.07.009.
- ↑ Organic Syntheses, Coll. Vol. 4, p.881 (1963); Vol. 36, p.86 (1956). Link
- ↑ Organotin chemistry 2004 Alwyn George Davies ISBN 3-527-31023-1
- ↑ Reich, Hans J. (1986). Lithium-Metalloid Exchange Reactions. Observation of Lithium Pentaalkyl/aryl Tin Ate Complexes. J. Am. Chem. Soc. 108: 2102. DOI: 10.1021/ja00268a067.
- ↑ V. G. Kumar Das, Lo Kong Mun, Chen Wei, and Thomas C. W. Mak (1987). Synthesis, Spectroscopic Study, and X-ray Crystal Structure of Bis[3-(2-pyridyl)-2-thienyl-C,N]diphenyltin(IV): The First Example of a Six-Coordinate Tetraorganotin Compound. Organometallics 6: 10. DOI: 10.1021/om00144a003.
- ↑ Masaichi Saito, Sanae Imaizumi, Tomoyuki Tajima, Kazuya Ishimura, and Shigeru Nagase (2007). Synthesis and Structure of Pentaorganostannate Having Five Carbon Substituents. J. Am. Chem. Soc. 129: 10974–10975. DOI: 10.1021/ja072478.









![{\displaystyle {\ce {{} \atop {R-X}+R'-SnR3->[{\ce {Pd\ catalyst}}]{R-R'}+XSnR3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc32d8bb27dcd1527df666b4e488674b353582cf)






![Tetraethyltin is een katalysator.[6]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1e/Tetraethyltin.svg/120px-Tetraethyltin.svg.png)