| Chloroplast | ||||
|---|---|---|---|---|
|
Onderdeel van celbiologie | ||||

| ||||
| Componenten van een chloroplast | ||||
| ||||
| ||||
Een thylakoïde is een membraan-omsloten compartiment in chloroplasten en cyanobacteriën. Thylakoïden bestaan uit een thylakoïdemembraan die het lumen (de binnenruimte) van de thylakoïde scheidt van het stroma van de chloroplast. Het woord thylakoïde komt van het Griekse woord thylakos (θύλακος) dat zak of buidel betekent.[1]
Thylakoïden liggen in chloroplasten als stapels munten op elkaar. Dergelijke stapels worden grana (meervoud van granum) genoemd. Grana zijn onderling verbonden door lange stromale thylakoïden, die alle thylakoïden van de chloroplast aaneensluiten tot een functioneel complex. Thylakoïden vormen de meest omvangrijke membraansystemen die in de cellulaire natuur voorkomen.
De membranen van thylakoïden bevatten moleculaire complexen of fotosystemen, die gebruikt worden bij de lichtreacties van de fotosynthese. Het vangen van de lichtenergie leidt in de thylakoïden tot een aantal complexe reactieketens, waaruit het autotrofe organisme zelf voedingsstoffen kan vormen. Het biologische pigment chlorofyl, dat in overvloed in thylakoïden is ingebed, geeft planten hun groene kleur en wordt gebruikt om elektronen, onder invloed van van invallend licht, te exciteren.
Ontdekking
De chloroplast, een groen celorganel dat voorkomt in planten, algen en sommige micro-organismen, werd voor het eerst waargenomen door Hugo von Mohl in 1837. Hij omschreef de chloroplast als een eenvoudig, afzonderlijk structuurtje die kenmerkend was voor de plantaardige cel.[2] Later in de negentiende eeuw borduurde de botanicus Andreas Schimper voort op de bevindingen van Von Mohl, en noemde de groene structuren in plantencellen "Chlorophyllkörner".[3] Schimper beschouwde chloroplasten en andere plastiden als pigmentdragende celonderdelen, die zich kunnen ontwikkelen uit kleurloze precursors.[4] Bij zijn waarnemingen had hij alleen de lichtmicroscoop ter beschikking, dus aanwijzingen voor thylakoïden bleven uit.
Kort na de uitvinding van de elektronenmicroscoop in 1931 werden de eerste beelden van de structuren binnen chloroplasten gepubliceerd. Elektronenmicroscopie werd daarna de voornaamste techniek om onderzoek te doen naar de verschillende plastiden, en hun complexe interne samenstelling. In de jaren vijftig was de structuur van thylakoïden in beginnende mate vastgesteld, en de functie ervan stond onder wetenschappers ter discussie.[5][6]
Structuur
In grote lijnen lijken thylakoïden in microscopische opnames op gestapelde, afgeplatte zakken die in het stroma, de grondvloeistof van de chloroplast, zijn ingebed. Er zijn globaal twee typen thylakoïden naar vorm te onderscheiden: de granumthylakoïden die in cilindrische stapels liggen, en de stromale thylakoïden die platter zijn en grana onderling verbinden. Ook bij cyanobacteriën komen thylakoïdesystemen voor. Deze liggen vrij in het cytosol.
De structuur van thylakoïden weerspiegelt hun functie van fotosynthese: een zeer groot membraanoppervlak om licht te vangen, en een dunne binnenruimte met een specifiek chemisch milieu, waarin energierijke moleculen worden gevormd. In de membranen van thylakoïden verlopen de processen die, via allerlei voedselketens, aan de basis liggen van alle ecosystemen: de synthese van organisch materiaal uit de anorganische verbindingen water en kooldioxide, onder gebruik van energie uit licht.
Granum
Bij vrijwel alle vaatplanten zijn de thylakoïden gebundeld in stapels genaamd grana.[8] In de chloroplasten van bepaalde mossen, varens, C4-planten en sommige algen zijn de thylakoïden meer amorf van structuur en liggen ze vrij in het stroma.[9] Met de elektronenmicroscoop is de structuur van het thylakoïdsysteem van vaatplanten in detail vastgesteld. Het thylakoïdsysteem bestond uit gestapelde, schijfvormige thylakoïden die onderling verbonden werden door lange lamellen genaamd stromale thylakoïden.[10] Een granum kan men beschouwen als een cilinder met een diameter van ongeveer 300–600 nanometer. De verbindende stromale thylakoïden zijn enkele millimeters lang en net zichtbaar met lichtmicroscopen. Onder de transmissie-elektronenmicroscoop (TEM) zijn de thylakoïdemembranen te zien als lichte en donkere strepen, ongeveer 8,5 nm dik.[10]
De driedimensionale structuur van het granumsysteem is al lange tijd onderwerp van onderzoek.[11] Onderzoek naar thylakoïden door middel van elektronentomografie leverden twee verschillende modellen. In het ene model werd het granum voorgesteld als een stapel thylakoïden die omgeven werd door een plat, spiraalvormig stromaal thylakoïde, zoals hierboven afgebeeld. Volgens het andere model werden thylakoïden verbonden door lineaire stromale thylakoïden, loodrecht op de granum-as. Hoewel grana over het algemeen nog steeds worden afgebeeld volgens het lineaire thylakoïdemodel,[12] werd in 2011 vastgesteld dat het spiraalvormige thylakoïdemodel correct is.[7]
In het spiraalvormig thylakoïdemodel is een granum opgebouwd uit granumthylakoïden. Eén granum kan twee tot honderd thylakoïden bevatten,[10] maar grana met tien thylakoïden komen het meest voor in chloroplasten.[8] De stromale thylakoïden snijden de horizontale thylakoïden in het granum onder een hoek van 20–25°. Door uit te groeien in de breedte kunnen de stromale thylakoïden andere grana met elkaar verbinden als een brugsysteem.[7] Hoewel de verschillende delen van het thylakoïdesysteem verschillende membraaneiwitten bevatten,[a] zijn de thylakoïdmembranen volledig doorlopend en is de binnenruimte die ze omsluiten een aaneengeschakeld labyrint.[8]
Dynamiek
De interne structuur van chloroplasten is voortdurend onderhevig aan verandering, afhankelijk van de hoeveelheid licht die de chloroplast binnenkomt.[14] De totale oppervlakte van het thylakoïdemembraan kan onder invloed van invallend licht variëren. Chloroplasten in de schaduw bevatten grotere grana en een groter thylakoïdemembraan-oppervlak dan chloroplasten die blootstaan aan fel licht. De veranderingen kunnen binnen enkele minuten optreden.[15]
Thylakoïden veranderen van structuur om fotosynthese zo stabiel en efficiënt mogelijk te laten verlopen. De dynamiek komt voornamelijk tot stand door een reorganisatie van eiwitcomplexen in de membranen. De mechanismen die hieraan ten grondslag liggen zijn nog maar gedeeltelijk begrepen. In onderzoeken wordt het vermogen van thylakoïden om zich in meerdere structuren te organiseren toegeschreven aan het zogenaamde lichtopvangsysteem II (LHCII), het grootste eiwitcomponent in grana dat een essentiële rol speelt in de lichtreactie. Structuurveranderingen vinden plaats door regulatie van interacties tussen LHCII en de thylakoïdemembranen.[16]
Thylakoïdemembraan

Het thylakoïdemembraan kan beschouwd worden als het belangrijkste onderdeel van de chloroplast, omdat in deze membranen moleculen en eiwitten zijn ingebed die reacties laten verlopen die essentieel zijn voor de fotosynthese. Eiwitten beslaan de overgrote meerderheid van het membraanoppervlak: lokaal wel tot 80%.[17]
Het thylakoïdemembraan heeft een unieke samenstelling: het is opgebouwd uit een dubbele laag lipiden, zeer vergelijkbaar met de dubbele laag fosfolipiden in celmembranen. De membranen van thylakoïden komen sterk overeen met de membranen van prokaryoten en met het binnenste chloroplastmembraan. Deze membranen kenmerken zich door de aanwezigheid van negatief geladen (zure) lipiden.[18] Een groeiend aantal studies wijst uit dat bijzondere lipidensamenstelling van thylakoïdemembranen essentieel zijn voor het juist functioneren van de fotosyntheseprocessen.[19]
Bij planten en cyanobacteriën bestaan de thylakoïdemembranen uit vier verschillende lipideverbindingen, die buiten chloroplasten in de natuur vrijwel niet voorkomen:[17][20] de galactolipiden MGDG (monogalacotosyldiglyceride) en DGDG (digalactosyldiacylglycerol), de sulfolipide SQDG (sulfoquinovosyldiacylglycerol) en de fosfolipide PG (fosfatidylglycerol). De galactolipiden maken het grootste deel uit van het membraan, namelijk ongeveer 70%.[17] Elke lipideverbinding heeft een eigen fysiochemische rol. De sulfolipiden en fosfolipiden zorgen ervoor dat er een lipide dubbellaag wordt gevormd waarin eiwitten kunnen worden verankerd.[21] De galactolipiden maken het mogelijk dat de membranen zich op elkaar stapelen tot een granum.[17] De onderlinge verhoudingen van de verschillende lipiden zijn redelijk constant, omdat het thylakoïdemembraan specifieke eigenschappen moet handhaven om goed te functioneren.
Synthese
De synthese van nieuwe thylakoïdmembraanonderdelen gebeurt bij planten in een wisselwerking tussen de chloroplast en het endoplasmatisch reticulum (ER). Vrije vetzuren, met name linoleenzuur,[22] zijn de voorloperstoffen van membraanlipiden en worden gevormd in de chloroplast zelf. Deze vetzuren worden van daaruit getransporteerd naar het ER waar ze worden samengesteld tot glyceriden: lipiden die het uiteindelijke thylakoïdmembraan vormen. De glyceriden keren terug naar de chloroplast waar ze voltooid worden, en via vesikels worden ze naar de thylakoïden gebracht waar ze zich organiseren tot membranen.[23] Het is echter nog niet geheel zeker hoe dit transport van lipiden precies verloopt.[17]
Omdat eiwitten een groot deel uitmaken van het thylakoïdmembraan wordt aangenomen dat ook zij een grote rol spelen in de biosynthese.[16] De meeste van deze eiwitten worden gecodeerd door kern-DNA, en moeten dus de chloroplast in getransporteerd worden. De processen die dit transport sturen zijn veelvuldig onderzocht.[24][25]
Lumen
De binnenruimte van een thylakoïde, het zogenoemde lumen, bestaat uit een waterige, dikke, homogene vloeistof die volledig wordt omsloten door het ondoordringbare thylakoïdemembraan. Het speelt een belangrijke rol bij fotofosforylering tijdens fotosynthese. Tijdens de lichtreacties worden waterstofionen (protonen) over het thylakoïdmembraan in het lumen gepompt. Het lumen verandert daarbij in een zuur milieu met een pH van ongeveer 4, dat sterk verschilt van de hogere pH in het stroma. Het enzymcomplex ATP-synthase in het membraan maakt gebruik van dit protonengradiënt. Het laat de protonen weer terugstromen een fosforyleert daarbij ADP tot ATP.
In het verleden dacht men dat het lumen vrij was van eiwitten.[26] Het bevat echter een veelheid aan enzymen en regulerende moleculen die een ondersteunende rol spelen bij de fotosyntheseprocessen. Daarnaast zijn de luminale eiwitten betrokken bij de flexibiliteit en het herstel van het thylakoïdemembraan.[26] De omvang van het lumen is zeer veranderlijk. Wanneer er licht op de thylakoïden valt, neemt het lumen toe in volume.[27] Men veronderstelt dat de eiwitten die nodig zijn voor fotosynthese op deze manier bij licht sneller naar het lumen diffunderen.[28] Ook de pH van het lumen wordt door invallend licht gereguleerd om eiwitinteracties te sturen.
Vorming en groei
De ontwikkeling van thylakoïden loopt parallel aan de ontwikkeling van de chloroplast zelf: de transformatie van een proplastide tot een volwassen plastide. De vorming van een thylakoïde vereist licht. Wanneer een plant te weinig krijgt, kunnen de thylakoïden zich onvoldoende ontwikkelen. De chloroplasten functioneren dan niet en de plant zal sterven. Wanneer het embryo van een plant onvoldoende licht krijgt, veranderen de proplastiden in etioplasten die semikristallijne membraanstructuren bevatten. In een later stadium kunnen deze membraanstructuren zich nog ontwikkelen tot thylakoïden.
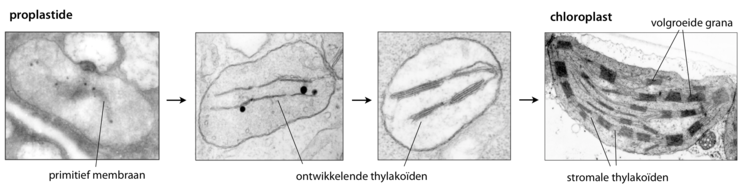
Proplastiden zijn kleine, ronde organellen die met de elektronenmicroscoop nauwelijks te onderscheiden zijn van mitochondriën. Ze bevatten een klein aantal interne membranen, vaak zichtbaar als zakvormige blaasjes of als instulpingen van het binnenmembraan.[4] Bij onderzoek naar grassen is duidelijk vastgesteld dat de thylakoïden zich tijdens de ontwikkeling van een chloroplast in opeenvolgende fasen opbouwen. Eerst worden er langwerpige, aaneengesloten lamellen gevormd die de gehele lengte van de plastide kunnen overspannen. Vervolgens groeien de lamellen op bepaalde plekken laaggewijs in de hoogte uit. Afhankelijk van het type plantencel zal het thylakoïdesysteem doorgroeien totdat tientallen granumstructuren tot stand zijn gekomen.
Voor de vorming van thylakoïden is een specifieke eiwitfamilie van bijzonder belang: de vesicle-inducing protein in plastids 1 (VIPP1). Lage VIPP1-concentraties in de cellen van planten leiden tot een trage groei en een bleker uiterlijk met verminderd vermogen tot fotosynthese. VIPP1 lijkt essentieel te zijn voor de ontwikkeling van thylakoïdemembranen, maar niet voor de verankering van chlorofyl en eiwitcomplexen in de thylakoïdmembranen.[29] VIPP1 is sterk geconserveerd onder organismen met thylakoïden, inclusief cyanobacteriën,[30] groenwieren zoals Chlamydomonas,[31] en hogere planten, zoals Arabidopsis thaliana.[32]
Moleculaire samenstelling

Thylakoïden hebben een complexe moleculaire opbouw. De membranen bevatten een veelheid aan integrale en perifere membraaneiwitten,[b] waarvan het grootste deel een directe functie verricht bij de fotosynthese en eiwitlokalisatie. Proteomica-onderzoeken hebben licht geworpen op de eiwitsamenstelling van thylakoïden. De hiervan verzamelde gegevens zijn in openbare databases vastgelegd.[33]
Naast eiwitten bevatten thylakoïden ook honderden organische co-enzymen zoals chlorofyllen, carotenoïden, cytochromen en chinonen, evenals metalen en bepaalde ionen. Deze moeten in het membraan bij elkaar worden gebracht en correct worden samengesteld. Alle moleculen moeten worden gesynthetiseerd in hoeveelheden die bij benadering gelijk zijn aan hun uiteindelijke stoichiometrie. De componenten worden in een stapsgewijze volgorde samengesteld. Het opbouwproces moet dus volledig geordend zijn, zowel in tijd als in ruimte.[17]
Membraaneiwitten
Het proteoom van thylakoïden bestaat uit minstens 335 verschillende eiwitten. Hiervan bevinden zich er 89 in het lumen, 116 zijn integrale membraaneiwitten, 62 zijn perifere eiwitten aan de stromazijde en 68 perifere eiwitten aan de luminale zijde. De aanwezigheid van sommige eiwitten die in zeer lage concentraties voorkomen in het lumen kan voorspeld worden met behulp van computermodellen.[34]
Fotosystemen
De belangrijkste en meest complexe membraaneiwitten die in thylakoïden voorkomen zijn de fotosystemen. Een fotosysteem bevat een lichtopvangsysteem (antenne) met verschillende fotosynthetiserende pigmenten zoals chlorofyl, carotenoïden en fycobilisoomeiwitten om licht te vangen bij veel verschillende golflengtes. De energie uit licht wordt in fotosystemen gebruikt om een reeks redoxreacties te laten verlopen die uiteindelijk NADP aan H+ koppelen zodat NADPH wordt gevormd. Het ontstane NADPH heeft een sterk reducerend vermogen dat nodig is in de calvincyclus, waarin koolhydraten worden geproduceerd. Tijdens de redoxreacties worden H+-ionen (protonen) over het thylakoïdemembraan getransporteerd, zodat binnen de thylakoïde een lagere pH heerst dan erbuiten. Het eiwit ATP-synthase dat verderop in het thylakoïdmembraan is ingebed vormt energierijke ATP-moleculen onder invloed van het aangelegde protonengradiënt.
Er zijn twee fotosystemen in thylakoïden ontdekt: fotosysteem II en fotosysteem I. Fotosysteem II bevat een speciaal chlorofylmolecuul dat P680 wordt genoemd. Het absorbeert licht het best bij een golflengte van 680 nanometer (nm). De P is een afkorting voor ‘pigment’.
Zie ook
Noten
Bronnen
- ↑ (en) θύλακος. Liddell, Henry George; Scott, Robert; A Greek–English Lexicon at the Perseus Project.
- ↑ (de) von Mohl, H. (1835/1837). Ueber die Vermehrung der Pflanzen-Zellen durch Teilung. Dissert. Tubingen 1835. Flora 1837, .
- ↑ (de) Schimper, A. F. W. (1883). Über die Entwicklung der Chlorophyllkörner und Farbkörper. Bot. Zeitung: 105–112; 121–131; 137–146; 153–160.
- ↑ a b (en) Ute Vothknecht, Peter Westhoff (2001). Biogenesis and origin of thylakoid membranes. Biochimica et Biophysica Acta (BBA) 1541 (1–2): 91-101. PMID 11750665.
- ↑ (en) von Wettstein, D (1959). The effect of genetic factors on the submicroscopic structures of the chloroplast.. J. Ultrastruc. Res. 3: 234-240.
- ↑ (de) Granick, S. et al (1955). Encyclopedia of Plant Physiology. Springer, Berlijn. Beschrijvingen van plastiden en thylakoïden in volume II, gedeelte F. Vrije toegang tot inhoud.
- ↑ a b c (en) Austin JR, Staehelin LA. (2011). Three-Dimensional Architecture of Grana and Stroma Thylakoids of Higher Plants as Determined by Electron Tomography. Plant Physiology 155 (4): 1601–11. PMID 21224341. DOI: 10.1104/pp.110.170647.
- ↑ a b c Mustardy L. Buttle K. Steinbach G. Garab G. (2008). The Three-Dimensional Network of the Thylakoid Membranes in Plants: Quasihelical Model of the Granum-Stroma Assembly. The Plant Cell Online 20 (10): 2552–7. PMID 18952780. PMC 2590735. DOI: 10.1105/tpc.108.059147.
- ↑ Kim E. Archibald JM. (2009). The Chloroplast. DOI:10.1007/978-3-540-68696-5_1, "Diversity and Evolution of Plastids and Their Genomes", 1–39. ISBN 978-3-540-68692-7.
- ↑ a b c Jeremy Burgess (1989). An introduction to plant cell development, Pbk.. Cambridge university press, Cambridge, p. 46. ISBN 0-521-31611-1.
- ↑ (en) Mustárdy L. Buttle K. Steinbach G. Garab G. (2008). The Three-Dimensional Network of the Thylakoid Membranes in Plants: Quasihelical Model of the Granum-Stroma Assembly. Plant Cell 20 (10): 2552–2557. PMID 18952780. PMC 2590735. DOI: 10.1105/tpc.108.059147.
- ↑ (en) Campbell et al. (2009). Biology 8th Edition Campbell & Reece. Benjamin Cummings (Pearson).
- ↑ (en) Andersson B, Anderson JM. (1980). Lateral heterogeneity in the distribution of chlorophyll–protein complexes of the thylakoid membranes of spinach chloroplasts. Biochimica et Biophysica Acta 593, 427–440. PMID 7236643
- ↑ (en) Anderson JM, Horton P, Kim EH, Chow WS. (2012). Towards elucidation of dynamic structural changes of plant thylakoid architecture.. Philosophical transactions of the Royal Society of London 367 (1608). PMID 23148278. DOI: 10.1098/rstb.2012.0373.
- ↑ (en) Wise, R.R. & Hoober, J.K. (2007). The Structure and Function of Plastids. Springer, 32–33. ISBN 978-1-4020-6570-5.
- ↑ a b Mathias Pribil, Mathias Labs, Dario Leister (2014). Structure and dynamics of thylakoids in land plants. Journal of Experimental Botany 65 (8): 1955–1972. PMID 24622954. DOI: 10.1093/jxb/eru090.
- ↑ a b c d e f (en) Rast A, Heinz S, Nickelsen J (2015). Biogenesis of thylakoid membranes. Biochimica et Biophysica Acta 1847: 821-830. DOI: 10.1016/j.bbabio.2015.01.007. Vrije toegang
- ↑ (en) Sato N (2004). Roles of the acidic lipids sulfoquinovosyl diacylglycerol and phosphatidylglycerol in photosynthesis: their specificity and evolution. J Plant Res 117 (6): 495–505. PMID 15538651. DOI: 10.1007/s10265-004-0183-1.
- ↑ (en) Van Eerden FJ, De Jong DH, et al. (2015). Characterization of thylakoid lipid membranes from cyanobacteria and higher plants by molecular dynamics simulations. Biochimica Et Biophysica Acta 1848 (6): 1319–1330. PMID 25749153. DOI: 10.1016/j.bbamem.2015.02.025.
- ↑ (en) Spraque SG (1987). Structural and functional organization of galactolipids on thylakoid membrane organization. J Bioenerg Biomembr 19 (6): 691–703. PMID 3320041. DOI: 10.1007/BF00762303.
- ↑ (en) YashRoy RC. (1990). Magnetic resonance studies of dynamic organization of lipids in chloroplast membranes. Journal of Biosciences 15 (4): 281–288. DOI: 10.1007/bf02702669.
- ↑ (en) YashRoy R.C. (1987). 13C NMR studies of lipid fatty-acyl chains of chloroplast membranes. Indian Journal of Biochemistry and Biophysics 24: 177–178.
- ↑ (en) Benning C, Xu C, Awai K (2006). Non-vesicular and vesicular lipid trafficking involving plastids. Curr Opin Plant Biol 9 (3): 241–7. PMID 16603410. DOI: 10.1016/j.pbi.2006.03.012.
- ↑ (en) Gutensohn M, Fan E, Frielingsdorf S, Hanner P, Hou B, Hust B, Klösgen RB. (2006). Toc, Tic, Tat et al.: structure and function of protein transport machineries in chloroplasts. Journal of Plant Physiology 163, 333–347. PMID 16386331 DOI:10.1016/j.jplph.2005.11.009
- ↑ (en) Shi LX, Theg SM. (2013) The chloroplast protein import system: from algae to trees. Biochimica et Biophysica Acta 1833, 314–331. PMID 23063942 DOI:10.1016/j.bbamcr.2012.10.002
- ↑ a b (en) Järvi S. Gollan PJ. & Aro EM. (2013). Understanding the roles of the thylakoid lumen in photosynthesis regulation. Frontiers in plant science 4 (434). PMID 24198822. DOI: 10.3389/fpls.2013.00434. vrije toegang
- ↑ (en) Mullineaux CW (2008). Factors controlling the mobility of photosynthetic proteins.. Photochem Photobiol.. PMID 18764904. DOI: 10.1111/j.1751-1097.2008.00420.x.
- ↑ (en) Kirchhoff H, Hall C, Wood M, et al. (2011). Dynamic control of protein diffusion within the granal thylakoid lumen. Proc Natl Acad Sci U S A. 108 (50): 20248–20253. PMID 22128333. DOI: 10.1073/pnas.1104141109. vrije toegang
- ↑ (en) Aseeva E, Ossenbühl F, Sippel C. et al. (2007). Vipp1 is required for basic thylakoid membrane formation but not for the assembly of thylakoid protein complexes. Plant Physiol Biochem 45 (2): 119–28. PMID 17346982. DOI: 10.1016/j.plaphy.2007.01.005.
- ↑ (en) Westphal S! Heins L, Soll J. et al (2001). Vipp1 deletion mutant of Synechocystis: A connection between bacterial phage shock and thylakoid biogenesis?. Proc Natl Acad Sci USA 98 (7): 4243–8. PMID 11274448. DOI: 10.1073/pnas.061501198.
- ↑ (en) Liu C, Willmund F, Golecki J et al. (2007). The chloroplast HSP70B-CDJ2-CGE1 chaperones catalyse assembly and disassembly of VIPP1 oligomers in Chlamydomonas. Plant J 50 (2): 265–77. PMID 17355436. DOI: 10.1111/j.1365-313X.2007.03047.x.
- ↑ (en) Kroll D, Meierhoff K, Bechtold N (2001). VIPP1, a nuclear gene of Arabidopsis thaliana essential for thylakoid membrane formation. Proc Natl Acad Sci USA 98 (7): 4238–42. PMID 11274447. DOI: 10.1073/pnas.061500998.
- ↑ (en) Kleffmann T, Hirsch-Hoffmann M, et al. (2006). plprot: a comprehensive proteome database for different plastid types. Plant Cell Physiol 47 (3): 432–6. PMID 16418230. DOI: 10.1093/pcp/pcj005. – Plastid Protein Database
- ↑ (en) Peltier J, Friso G, Kalume D, Roepstorff P et al. (2000). Proteomics of the Chloroplast: Systematic Identification and Targeting Analysis of Lumenal and Peripheral Thylakoid Proteins. Plant Cell 12 (3): 319–41. PMID 10715320. DOI: 10.1105/tpc.12.3.319.
Literatuur
- (en) Blankenship, R. (2002). Molecular Mechanisms of Photosynthesis. Blackwell Science. ISBN 978-0-632-04321-7.
- (en) Vothknecht U, Westho P. (2001). Biogenesis and Origin of Thylakoid Membranes. Biochimica et biophysica 1541: 91-101.
- (en) Peter H. Raven (2013). Biology of Plants, 8th edition. W.H. Freeman Publishers. ISBN 9781464113512.
- (en) Krumova, S.K.B. (2009). The role of lipids in the global organization of thylakoid membranes of higher plants. Wageningen University & Research E-depot. ISBN 9789085852926. Vrije toegang tot proefschrift
- (en) Bastien O, Botella C. (2016). Chapter One - New Insights on Thylakoid Biogenesis in Plant Cells. International Review of Cell and Molecular Biology 323: 1-30. ISSN: 1937-6448.









![Granumstructuur. Het leidende model voor de structuur van grana is een stapel thylakoïden die verbonden zijn door spiraalvormige stromale thylakoïden. Zij wikkelen rond de thylakoïd-stapels en verbinden alle grana in de chloroplast.[7]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7c/Granumstructuur.png/432px-Granumstructuur.png)