| Chemische binding | ||||
|---|---|---|---|---|

| ||||
| Dipool-dipoolinteractie | ||||
| Moleculen (intramoleculair) | ||||
| Moleculen (intermoleculair) | ||||
| Zouten | ||||
| Metalen | ||||
| Covalente netwerken | ||||
| Theorieën | ||||
| Eigenschappen | ||||
| ||||
De valentieschil-elektronenpaar-repulsie-theorie (meestal benoemd als VSEPR-theorie) is een theorie die de geometrie van covalente bindingen verklaart aan de hand van Paulirepulsie tussen valentie-elektronen. De theorie gaat ervan uit dat de atomen in een molecuul zich rond één centraal atoom bevinden en wel zodanig dat hun onderlinge afstand zo groot mogelijk is. Verder wordt aangenomen dat dit ook geldt voor vrije elektronparen.
Sterisch getal
Het sterisch getal is de som van het aantal bindingpartners en het aantal vrije elektronenparen. Dit getal varieert van 2 tot 6. Onderstaande tabel geeft een overzicht van sterische getallen van enkele verbindingen:
| Sterisch getal | Voorbeeld |
|---|---|
| 2 | Be in BeCl2 |
| 3 | B in BF3 S in SO3 |
| 4 | C in CH4 N in NH3 |
| 5 | P in PCl5 |
| 6 | S in SF6 |
Basisgeometrie
Alle elektronenparen in een molecuul oefenen repulsieve coulombkrachten op elkaar uit. Als gevolg hiervan oriënteren alle elektronenparen zich zodanig op een denkbeeldig boloppervlak, dat hun onderlinge afstand maximaal is. Daardoor krijgen alle covalente bindingen met eenzelfde sterisch getal steeds 1 unieke moleculair-geometrische basisconfiguratie:
- 2: lineair
- 3: trigonaal planair (VEP=0: vlak-trigonaal, VEP=1: V-vorm of gekikt, VEP=2, lineair)
- 4: tetraëdrisch (VEP=0: tetraëder, VEP=1: trigonale piramide, VEP=2: V-vorm of gekinkt, VEP=3: lineair)
- 5: trigonaal bipiramidaal
- 6: octaëdrisch
Werkelijke geometrie
De werkelijke geometrie komt niet steeds overeen met de basisconfiguraties. Niet zelden bezitten elementen één of meerdere vrije elektronenparen. Deze werken de repulsieve interacties nog sterker in de hand. Desgevolgend ontstaan er veel meer mogelijkheden, afhankelijk van het aantal vrije elektronenparen. Onderstaande tabel geeft een overzicht van de meest voorkomende moleculaire geometrieën:
| AXE-symbool | B. p. | V. p. | Moleculaire geometrie | Hoek(en) | Voorbeeld | Structuur |
|---|---|---|---|---|---|---|
| AX2E0 | 2 | 0 | lineair | 180° | BeCl2 | |
| AX3E0 | 3 | 0 | trigonaal planair | 120° | BF3 | 
|
| AX2E1 | 2 | 1 | geknikt | < 120° | SO2 | 
|
| AX4E0 | 4 | 0 | tetraëder | 109,5° | CH4 | 
|
| AX3E1 | 3 | 1 | trigonale piramide | 107° < 109,5˚ | NH3 | 
|
| AX2E2 | 2 | 2 | gebogen | 105˚< 109,5˚ | H2O | 
|
| AX5E0 | 5 | 0 | trigonale bipiramide | 90°, 120° | PCl5 | 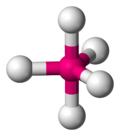
|
| AX4E1 | 4 | 1 | seesaw | 90°, 120°, 180° | SF4 | 
|
| AX3E2 | 3 | 2 | T-vormig | 90°, 180° | ClF3 | 
|
| AX2E3 | 2 | 3 | lineair | 180° | XeF2 | 
|
| AX6E0 | 6 | 0 | octaëder | 90° | SF6 | 
|
| AX5E1 | 5 | 1 | vierkante piramide | 90° | BrF5 | 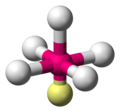
|
| AX4E2 | 4 | 2 | vierkant planair | 90° | PtCl4 | 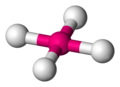
|
| AX5E2 | 5 | 2 | pentagonaal planair | 72° | XeF5- | |
| AX6E1 | 6 | 1 | pentagonale piramide | 90°, 72° | IOF52− | 
|
| AX7E0 | 7 | 0 | pentagonale bipiramide | 90°, 72° | IF7 | 
|








