| Azijnzuur | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
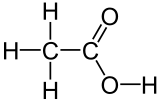
Structuurformule van azijnzuur
| ||||

| ||||
Molecuulmodel van azijnzuur
| ||||

| ||||
| Algemeen | ||||
| Molecuulformule | C2H4O2 of | |||
| IUPAC-naam | ethaanzuur | |||
| Andere namen | waterstofacetaat (incorrect) | |||
| Molmassa | 60,05196 g/mol | |||
| SMILES | CC(=O)O
| |||
| InChI | 1/C2H4O2/c1-2(3)4/h1H3,(H,3,4)/f/h3H
| |||
| CAS-nummer | 64-19-7 | |||
| EG-nummer | 200-580-7 | |||
| PubChem | 176 | |||
| Wikidata | Q47512 | |||
| Beschrijving | Kleurloze vloeistof met een stekende geur | |||
| Vergelijkbaar met | mierenzuur | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H226 - H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P305+P351+P338 - P310 | |||
| EG-Index-nummer | 607-002-00-6 | |||
| VN-nummer | 2789 | |||
| ADR-klasse | Gevarenklasse 8 | |||
| LD50 (ratten) | 3310 mg/kg | |||
| LD50 (konijnen) | 1113 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,0492 g/cm³ | |||
| Smeltpunt | 16,6[1] °C | |||
| Kookpunt | 117,9 °C | |||
| Vlampunt | 40 °C | |||
| Zelfontbrandings- temperatuur | 400 °C | |||
| Dampdruk | 15400 Pa | |||
| Goed oplosbaar in | water, ethanol, glycerol, di-ethylether, tetrachloormethaan | |||
| Onoplosbaar in | koolstofdisulfide | |||
| log(Pow) | −0,322 | |||
| Brekingsindex | 1,373 | |||
| Geometrie en kristalstructuur | ||||
| Dipoolmoment | 1,74 D | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
−432,2 kJ/mol | |||
| ΔfH |
−484,3 kJ/mol | |||
| S |
283,5 J/mol·K | |||
| S |
159,8 J/mol·K | |||
| Evenwichtsconstante(n) | pKa = 4,75 | |||
| Nutritionele eigenschappen | ||||
| Type additief | conserveermiddel, zuurregelaar, smaakstof | |||
| E-nummer | E260 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Azijnzuur (systematische naam ethaanzuur) is een zwak zuur met een kenmerkende stekende geur. Het heeft als formule CH3-COOH (soms ook geschreven als H3C-COOH). Azijnzuur is, na mierenzuur, het eenvoudigste carbonzuur en de wetenschappelijke naam was vroeger dan ook methaancarbonzuur. Zuiver watervrij azijnzuur wordt ook wel ijsazijn genoemd, en is een kleurloze vloeistof die bij temperatuur lager dan 17 °C stolt tot heldere kleurloze kristallen (vandaar de naam ijsazijn). Indien ijsazijn in een (trillingvrije) koelkast wordt geplaatst, kan het tot beneden het stolpunt worden gekoeld terwijl het toch een vloeistof blijft. Het is dan een onderkoelde vloeistof geworden; een geringe fysieke verstoring doet de vloeistof dan direct stollen.
Natuurlijk voorkomen
In het menselijk lichaam komt azijnzuur voornamelijk gebonden aan het Co-enzym A (CoA) voor, een stof die uitermate belangrijk is voor vele biochemische processen. Daarnaast vormt azijnzuur met choline de ester acetylcholine, een zeer veel voorkomende en belangrijke neurotransmitter. Het azijnzuur dat bij de biochemische processen vrijkomt, wordt doorlopend hergebruikt. Daarnaast komt azijnzuur voor in bepaalde bacteriën, in sommige planten en vele vruchten.

(aangegeven met groene streepjes)
Synthese
Het bereiden van azijn als voedingsmiddel werd vroeger uitsluitend gedaan door alcohol te laten fermenteren. Wijnazijn is daar een mooi voorbeeld van, maar ook de huidige tafelazijn wordt gemaakt van alcohol. Deze azijn heet natuurazijn. Azijn is ook chemisch te maken. Het verschil is dan onder andere dat er een hogere concentratie mogelijk is. Synthetische azijn wordt gemaakt uit een fossiele grondstof, zoals aardgas. Het verschil tussen synthetische azijn en natuurazijn is dan ook te bepalen met C14-datering.
Voor industrieel gebruik zijn er andere synthesemethodes:
- Uit methanol en koolstofmonoxide wordt azijnzuur gemaakt met behulp van een katalysator (kobalt-, rodium- of indiumverbindingen) bij circa 180 °C en onder hoge druk (30 tot 40 atmosfeer). Dit proces, het Monsanto-proces, is wereldwijd het meest gebruikt voor de productie van azijnzuur. De omzetting tot azijnzuur is zeer hoog (ca. 99%).
- Uit aceetaldehyde door oxidatie aan de lucht met behulp van een katalysator (mangaan-, kobalt en chroomzouten).
- Uit butaan door oxidatie aan de lucht met behulp van een katalysator (mangaan, kobalt en chroomzouten) en onder verhoogde temperatuur.
- Uit een reactie van water met azijnzuuranhydride ontstaat azijnzuur.
Toepassingen
Industrie
Zuiver azijnzuur is een belangrijke grondstof in de polymeerchemie waarbij celluloseacetaat en polyvinylacetaat gemaakt worden voor onder meer synthetische vezels, plastics en lijmen. Azijnzuuranhydride is daarin een belangrijke tussenstof. Ook acetaten (azijnzure zouten) zijn belangrijke eindproducten.
Met alcoholen vormt azijnzuur esters die als oplosmiddel of geurstof gebruikt worden.
Voeding
Azijnzuur en sommige acetaten worden gebruikt als smaakstof, conserveermiddel of zuurteregelaar in de voedingsmiddelenindustrie. Dit zijn:
- E 260 - Azijnzuur
- E 261 - Kaliumacetaat
- E 262 - Natriumacetaat
- E 263 - Calciumacetaat
Azijn is een oplossing van 4 tot 15% azijnzuur in water. Azijn wordt gebruikt bij het inmaken van groentes en de bereiding van diverse sauzen, zoals mosterd.
Schoonmaak
Azijnzuur wordt ook gebruikt als schoonmaakmiddel en dan vooral voor het verwijderen van kalkaanslag (dit is vooral calcium- en magnesiumcarbonaat). Vanuit milieuoogpunt heeft het gebruik van azijnzuur als schoonmaakmiddel het voordeel dat het zelf een veel voorkomend natuurproduct is, en dus als stof (bij voldoende verdunning) geen problemen geeft bij de biodegradatie. Daar azijnzuur metalen en bepaalde kunststoffen aantast is echter af te raden het als ontkalker te gebruiken in apparaten.
Onkruidbestrijding
Azijnzuur wordt, vanaf een concentratie van 5%, ook gebruikt bij de bestrijding van onkruid.[2]
Zie ook
Externe links
 azijnzuur - International Chemical Safety Card
azijnzuur - International Chemical Safety Card- (en) Gegevens van azijnzuur in de GESTIS-stoffendatabank van het IFA
- ↑ . GEEN TITEL OPGEGEVEN Gegevens in GestisDatabank: azijnzuur , geraadpleegd op: 15 juni 2015
- ↑ (en) Webber, Charles, Impact of Acetic Acid Concentration, Application Volume, and Adjuvants on Weed Control Efficacy. Journal of Agricultural Science (15 juli 2018). Geraadpleegd op 26 juli 2022.











