| L-cysteïne | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
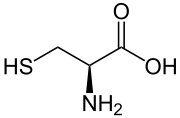
Structuurformule van L-cysteïne
| ||||

| ||||
Molecuulmodel van L-cysteïne
| ||||
| Algemeen | ||||
| Molecuulformule | C3H7NO2S | |||
| IUPAC-naam | L-Cysteine | |||
| Andere namen | thioserine, (R)-2-amino-3-mercaptopropaanzuur | |||
| Molmassa | 121,15718 g/mol | |||
| CAS-nummer | 52-90-4 | |||
| EG-nummer | 200-158-2 | |||
| PubChem | 5862 | |||
| Wikidata | Q186474 | |||
| LD50 (ratten) | (oraal) 1890 mg/kg (intraperitoneaal) 1620 mg/kg (subcutaan) 1550 mg/kg (intraveneus)1140 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos | |||
| Smeltpunt | 220 °C | |||
| Oplosbaarheid in water | 280 g/L | |||
| Goed oplosbaar in | water, ethanol, azijnzuur | |||
| Slecht oplosbaar in | di-ethylether, benzeen | |||
| Evenwichtsconstante(n) | pKz1 (COOH) = 1,91[1] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Cysteïne (afgekort als Cys of C) is een van de twintig natuurlijk in eiwitten voorkomende aminozuren. In zuivere vorm is cysteïne een kleurloze vaste stof met een karakteristieke geur en het is goed oplosbaar in water. Cysteïne is, net als methionine, een van de twee natuurlijke aminozuren die zwavel bevatten.
De zijketen van cysteïne bestaat uit een thiolgroep. Thiolen zijn reactief en hierdoor speelt cysteïne een belangrijke rol in enzymatische reacties als nucleofiel. De thiolgroep kan bovendien reageren met een andere thiolgroep, bijvoorbeeld die van een ander cysteïne-residu in de peptideketen, waarbij een zwavelbrug wordt gevormd. Zwavelbruggen zijn van groot belang bij de stabiliteit van de eiwitstructuur. Cysteïne komt dan ook veel voor in stevige eiwitvezels, zoals keratine en bindweefsels.
Cysteïne wordt geclassificeerd als een voor mens en dier niet-essentieel aminozuur, omdat het lichaam onder normale omstandigheden cysteïne kan synthetiseren uit serine en methionine. In zeldzame gevallen kan cysteïne wel essentieel zijn, bijvoorbeeld bij ouderen of mensen met malabsorptiesyndromen.
Synthese
Industriële productie
Op industriële schaal wordt cysteïne bereid door hydrolyse van haren (deze bevatten tot 14% cysteïne) en van eendenveren. China is een van de belangrijkste producenten van cysteïne.
Het is ook mogelijk om cysteïne via een organische synthese met behulp van een E. coli mutant te maken, maar de kostprijs hiervan is veel hoger. Het bedrijf Wacker Chemie heeft een chemische synthese ontwikkeld op basis van gesubstitueerde thiazolines.[2] Dit proces verloopt in twee stappen: eerst reageert de dubbele binding van de thiazolinering met waterstofcyanide, waarbij het overeenkomstig nitril ontstaat. Vervolgens wordt het nitril gehydrolyseerd met waterstofchloride en water, waarbij een ringopening leidt tot het hydrochloride van cysteïne.
Biosynthese
De biosynthese van cysteïne in dieren start met het aminozuur serine en homocysteïne. Homocysteïne wordt gevormd uit methionine via het intermediair S-adenosylmethionine. Het enzym cystathionine-bèta-synthase combineert serine en homocysteïne via een condensatiereactie tot de asymmetrische thio-ether cystathionine. Dit wordt vervolgens, met het enzym cystathionine-gamma-lyase, omgezet in cysteïne en alfa-ketobutyraat.
In planten en bacteriën start de biosynthese eveneens met serine, dat omgezet wordt in de ester O-acetylserine middels het enzym transacetylase. Het enzym O-acetylserinethiollyase zet dit intermediair om in cysteïne en acetaat.
Structuur
Het residu van cysteïne is een thiolgroep die via een methyleengroep verbonden is met het centraal α-koolstofatoom. Door aanwezigheid van de thiolgroep bestaat mogelijkheid tot deprotonering, waarbij het thiolaat ontstaat. Deze deprotonering treedt pas op onder basische omstandigheden. Cysteïne wordt geclassificeerd als een hydrofoob aminozuur. Desondanks is het goed oplosbaar in water, ethanol en azijnzuur. De reden hiervoor is de aanwezigheid van de polaire amine- en carbonzuurfunctie.
Eigenschappen
De thiolgroep in cysteïne bezit duidelijk nucleofiele eigenschappen en neemt als zodanig deel aan enzymatische reacties. Wanneer het aan lucht wordt blootgesteld oxideert het tot cystine, waarbij een zwavelbrug gevormd wordt. Dit structuurelement is van belang in verschillende eiwitten, onder andere in keratine.
De zuurconstanten van cysteïne zijn:[3]
- pKa1 (carboxylgroep) = 1,96
- pKaR (thiolgroep) = 8,27
- pKa2 (aminegroep) = 8,18
Het iso-elektrisch punt ligt bij pH 5,07.[3]
Cysteïne wordt gecodeerd door de codons UGU en UGC.
Biologische en biochemische functies
Precursor van glutathion
Cysteïne is een antioxidant omdat het zwavel in een lage oxidatietoestand bevat. Antioxidanten vangen zuurstofradicalen (deze zijn afvalproducten van de celmetabolisme). Cysteïne is meer bepaald een precursor voor het tripeptide glutathion. Dit tripeptide wordt via biosynthese gevormd uit de aminozuren cysteïne, glycine en glutaminezuur. Deze laatste twee zijn zeer toegankelijk door opname uit voeding, maar cysteïne veel minder en is dus de beperkende factor.
Zwavelbruggen
De vorming van zwavelbruggen of disulfidebruggen door oxidatie van cysteïne is een belangrijke stabiliserende structurele factor bij bepaalde eiwitten. Aangezien de omstandigheden in cellen meestal reducerend van aard zijn, zijn zwavelbruggen niet stabiel, hoewel er uitzonderingen bestaan. De vorming van zwavelbruggen is dus hoofdzakelijk voorbehouden voor proteïnen die zich in het extracellulair milieu bevinden.[4]
Zwavelbruggen kunnen enkel door cysteïne gevormd worden, niet door methionine. Dat komt doordat methionine geen thiolgroep bevat, maar een thio-ethergroep. Met agressieve oxidatoren wordt cysteïne omgezet in het overeenkomstige sulfien- en sulfonzuur. De gevormde zwavelbrug treedt meestal op als een soort crosslink tussen bepaalde delen in een proteïne of tussen proteïnen onderling. Hierdoor ontstaat een zekere vorm van rigiditeit in de tertiaire structuur van het proteïne. Insuline en keratine zijn voorbeelden van proteïnen met zwavelbruggen.
De vorming van zwavelbruggen wordt gekatalyseerd door het enzym disulfide-isomerase in het endoplasmatisch reticulum.
Bepaalde stoffen, zoals joodaceetamide, kunnen de vorming van zwavelbruggen verhinderen.
Precursor van ijzer-zwavelclusters
Cysteïne is een zeer belangrijke bron van zwavel in het menselijk metabolisme. Het sulfide in ijzer-zwavelclusters en in nitrogenase wordt onttrokken aan cysteïne.[5]
Metaalioncomplexen
Naast ijzer kunnen nog tal van andere metalen als cofactor dienen in enzymen waarin het thiolaat (de gedeprotoneerde vorm van het thiol) voorkomt. Voorbeelden zijn zink (in alcoholdehydrogenase), koper, ijzer (in cytochroom P450) en nikkel (in NiFe-hydrogenasen).
De thiolgroep bezit een hoge affiniteit voor zware metalen, waaronder kwik, lood en cadmium.[6] Dit wordt voorspeld op basis van de HSAB-theorie.
Rol in het schaap
Cysteïne is voor schapen noodzakelijk om wol te kunnen produceren.[7] Voor het schaap is cysteïne een essentieel aminozuur, dat wil zeggen dat het schaap deze stof niet zelf kan maken en dus uit het voedsel (gras) moet worden gehaald. Dit betekent dat schapen, wanneer ze in droogteperioden onvoldoende gras kunnen eten, ophouden met het produceren van wol.
Nutritionele eigenschappen en voorkomen
Hoewel het geclassificeerd wordt als een niet-essentieel aminozuur, blijkt cysteïne wel essentieel te zijn voor kinderen en oudere mensen. Onder normale omstandigheden, wanneer voldoende methionine (een essentieel aminozuur) aanwezig is, kan het relatief gemakkelijk biosynthetisch gevormd worden. De aanbevolen dagelijkse hoeveelheid ligt op 14,5 mg per kilogram lichaamsgewicht. Het E-nummer van L-cysteïne is E920.
Cysteïne komt voor in talrijke soorten voeding, waaronder varkensvlees, kippenvlees, kalkoen, eend, eieren, melk, ricotta, yoghurt, Spaanse peper, knoflook, ui, broccoli, spruitjes, haver en linzen. Het wordt ook toegepast als broodverbeteraar. Cysteïne zorgt ervoor dat brooddeeg minder plakkerig wordt en op industriële schaal beter te hanteren is. Binnen de Europese Unie is het gebruik van menselijke haren als grondstof voor voedingsadditieven overigens verboden.[8]
Externe links
- (en) MSDS van L-cysteïne
- (en) Gegevens van cysteïne in de GESTIS-stoffendatabank van het IFA
- ↑ a b c David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90e editie. (internetversie: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of Amino Acids, p. 7-1.
- ↑ (en) J. Martens, H. Offermanns & P. Scherberich (1981) - Facile Synthesis of Racemic Cysteine, Angew. Chem. Int. Ed. Engl., 20 (8), p. 668
- ↑ a b (en) F.A. Carey (2001) - Organic Chemistry (5th Ed.), The McGraw Companies, p. 1059
- ↑ (en) C.S. Sevier & C.A. Kaiser (2002) - Formation and transfer of disulphide bonds in living cells, Nature Rev. Mol. Cell. Biol., 3 (11), pp. 836-847
- ↑ (en) R. Lill & U. Mühlenhoff (2006) - Iron-Sulfur Protein Biogenesis in Eukaryotes: Components and Mechanisms, Ann. Rev. Cell Dev. Biol., 22, pp. 457-486
- ↑ (en) D.H. Baker & G.L. Czarnecki-Maulden (1987) - Pharmacologic role of cysteine in ameliorating or exacerbating mineral toxicities, J. Nutr., 117 (6), pp. 1003-1010
- ↑ (en) B.C. Powell, S.K. Walker, C.S. Bawden, A.V. Sivaprasad & G.E. Rogers (1994) - Transgenic sheep and wool growth: possibilities and current status, Reprod. Fertil. Dev., 6 (5), pp. 615-623. Gearchiveerd op 24 september 2015.
- ↑ Commission Directive 2008/84/EC of 27 August 2008 laying down specific purity criteria on food additives other than colours and sweeteners. Gearchiveerd op 19 juni 2023.








